Der wohl bekannteste Rückschlag in der Geschichte der Impfstoffentwicklung geht auf ein Ereignis im Jahr 1967 zurück. Nach Verabreichung einer experimentellen RSV-Impfung verstarben mehrere Kinder. Die Impfungen haben die Krankheit nicht verhindert, sondern massiv verstärkt. Nun kommen erstmals wieder RSV-Impfungen zum Einsatz.
Seit der Entdeckung des Respiratorischen Synzytial-Virus (RSV) im Jahr 1956 wurde jahrzehntelang vergeblich an einem wirksamen Impfstoff geforscht. Ein erster Versuch mit einem inaktivierten Impfstoff führte im Winter 1967 zu schweren Krankheitsverläufen bei Säuglingen, von denen zwei an ungewöhnlich massiven Komplikationen verstarben.[1] Dieses Desaster beendete die Entwicklung eines RSV-Impfstoffes für viele Jahrzehnte und gilt bis heute als Warnung vor infektionsverstärkenden Antikörpern (Antibody Dependent Enhancement (ADE) oder Vaccine Associated Enhanced Disease (VAED)).
Neutralisierende und nicht-neutralisierende Antikörper
Mit jeder Impfung sollen immunologische Prozesse ausgelöst werden, die zur Bildung spezifischer Antikörper führen. Sogenannte neutralisierende Antikörper sollen sich an die Oberfläche eines Erregers legen, diesen dadurch eliminieren und so den Ausbruch der Krankheit verhindern. Kommt es jedoch zur Bildung nicht-neutralisierender Antikörper, binden sich diese zwar ebenfalls an die Oberfläche eines Erregers, eliminieren diesen jedoch nicht. Ungünstigerweise ermöglicht diese Form der Antikörper die Aufnahme des Erregers in die Zellen. Eine massive Vermehrung des Erregers im Körper sowie stärkere und längere Krankheitssymptome sind die Folge. Geimpfte Menschen erkranken in solchen Fällen schwerer als Menschen ohne Impfung.[2]
Erst ab den 1990er Jahren war die Forschung so weit, die immunologischen Prozesse nachzuvollziehen, die der inaktivierte RSV-Impfstoff damals in den Säuglingen ausgelöst hat. Es gelang dennoch lange Zeit nicht, die Bildung neutralisierender Antikörper durch einen RSV-Impfstoff anzuregen. Die Entwicklung eines RSV-Impfstoffes, der diese gefährliche Immunreaktion nicht auslöst, zog sich somit weitere Jahrzehnte hin.[3]
Der Effekt einer von Antikörpern verursachten Verschlimmerung durch Impfungen tritt ein, wenn ein Mensch erst geimpft wird und zu einem späteren Zeitpunkt auf natürlichem Wege mit dem Erreger in Kontakt kommt. Hatte der Mensch vor einer Impfung bereits Kontakt mit dem Erreger, besteht dieses Risiko weit weniger. Insbesondere Babys und Kleinkinder werden geimpft, um schwere Erkrankungen in den ersten Lebensjahren damit möglicherweise zu verhindern. In der Regel sind dies gleichzeitig auch die Altersgruppen, die durch frühe Impfungen zur Bildung von Antikörper angeregt werden und dann im Laufe ihres Lebens zwangsläufig mit dem Erreger in Kontakt kommen. Die fatalen Verläufe nach RSV-Impfungen sowie die fatalen Verläufe nach Dengue-Impfungen im Rahmen eines Impfprogramms auf den Philippinen im Jahr 2016 zeigten jeweils dieses Muster.[4]
Impfungen in der Schwangerschaft als Ausweg
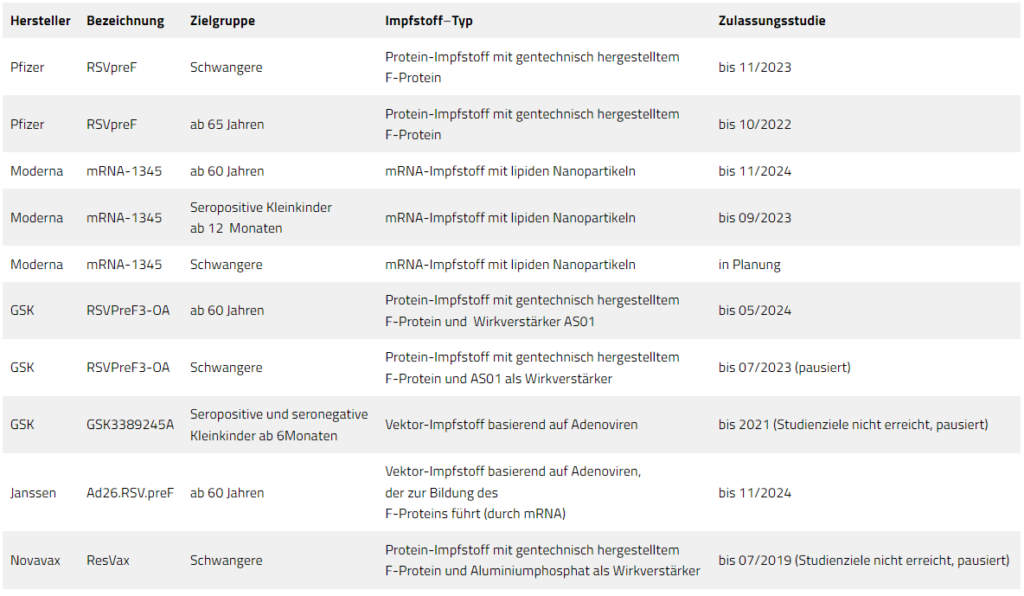
Als Ausweg aus diesem Dilemma werden nun RSV-Impfungen in der Schwangerschaft getestet. Denn ausschließlich in der Schwangerschaft, bevor ein Neugeborenes erstmals auf seine Umwelt trifft, kann garantiert werden, dass ein Baby noch keinerlei Kontakt mit dem RS-Virus hatte. Schwangere Frauen bilden damit eine große Zielgruppe der kommenden RSV-Impfungen, wie die Zulassungsstudien von Pfizer, Moderna, Glaxo-Smith-Kline und Novavax zeigen (siehe Übersicht unten).
Es wird vermutet, dass das Neugeborene auf diesem Weg durch mütterliche Antikörper vor Erkrankung und infektionsverstärkenden Antikörpern geschützt wird. Wie realistisch diese Annahme ist, wird sich jedoch erst im weiteren Verlauf der Studien oder – das ist wahrscheinlicher – mit Beginn der Impfungen herausstellen.
Die Sicherheit von Impfungen, die Schwangeren gegeben werden und somit den Verlauf der weiteren Schwangerschaft und die Entwicklung des Ungeborenen beeinflussen, sollte den höchsten Anforderungen entsprechen. Insbesondere, da es sich hierbei um genbasierte Vektor- und mRNA-Impfstoffe sowie gentechnisch hergestellte Protein-Impfstoffe handelt. Derzeitige Studien sehen beispielweise eine Nachverfolgung der Babys geimpfter Mütter zwischen 12 und 24 Monaten vor. Aktuell ist jedoch noch nicht einsehbar, welche konkreten gesundheitlichen Aspekte die Impfstoffhersteller im Rahmen ihrer Studien bei den geborenen Babys erfassen wollen. Entsprechend der laufenden Studien werden die Ergebnisse dazu kaum vor 2024/2025 veröffentlicht. Eine Untererfassung gesundheitlicher Probleme der Kinder ist zu befürchten, wenn Symptome im Abstand von 12 oder gar 24 Monaten nach der mütterlichen Impfung nicht mehr auf den Einfluss der Impfung zurückgeführt werden. Die aktuelle Debatte um Langzeitfolgen von COVID-19-Impfstoffen, wo ein kausaler Zusammenhang zumeist selbst bei einem nahen zeitlichen Bezug von wenigen Tagen pauschal abgesprochen wird, lässt zumindest Zweifel an der sorgfältigen Prüfung über einen derart langen Zeitraum aufkommen.
Wirtschaftliche Kalkulation zur Impfung von Senioren
Eine weitere große Zielgruppe der kommenden RSV-Impfungen bilden ältere Erwachsene ab 60 Jahren. Ab dieser Altersgruppe nimmt der Anteil der Menschen mit chronischen Vorerkrankungen in allen westlichen Industrieländern stetig zu. Eine RSV-Infektion bei vorerkrankten Senioren könnte wie bei Kleinkindern zu gefährlichen Krankheitsverläufen führen. Nahezu alle Impfstoffhersteller richten sich auf die Zielgruppe der Senioren aus – sicher auch, weil in diesem Alter der vorherige Kontakt mit RS-Viren als gesichert angenommen werden darf und damit die Gefahr infektionsverstärkender Antikörper weit weniger besteht. Dagegen stehen die Überlegungen, ob eine Impfung von Senioren grundsätzlich nötig ist, sich in den Altersgruppen als effektiv herausstellt und auch bei Vorerkrankungen als sicher betrachtet werden kann?
Auffallend in der Entwicklung der kommenden RSV-Impfstoffe für die Altersgruppe ab 60 Jahren ist, dass hier seitens der Impfstoffhersteller stark auf die wirtschaftliche Kalkulation gesetzt wird.[5] Die Fragen, denen dabei nachgegangen wird, lauten: Wie teuer ist die Behandlung einer schwer verlaufenden RSV-Erkrankung für das nationale Gesundheitssystem? Entsprechend wie hoch belaufen sich die Einsparungen für das nationale Gesundheitssystem, sobald eine RSV-Impfung für Personen ab 60 Jahren zur Verfügung steht? Vor dem Hintergrund überlasteter Kliniken und steigender Krankenkassenbeiträge in Deutschland könnten sich diese modellierten Einsparungen durchaus in der Werbung für die kommenden RSV-Impfungen widerspiegeln.
Seropositive und seronegative Kleinkinder
Kleinkinder sind – anders als die oben erwähnten Zielgruppen der Schwangeren und Senioren – die Altersgruppe, wo die Gefahr einer Krankheits-Verschlimmerung nach Impfung am größten gilt. Sich dieser Gefahr vollkommen bewusst, unterscheiden die Impfstoffhersteller in ihren Studien die teilnehmenden Kinder mit nachweislich vorherigem RSV-Kontakt (seropositiv im Blutbild) oder ohne nachweislich vorherigen RSV-Kontakt (seronegativ im Blutbild). Seronegative Kleinkinder sind aus jahrzehntelanger Erfahrung in der RSV-Impfstoffentwicklung die kritischste Gruppe[6] – was übersetzt für die Impfstoffhersteller das höchste wirtschaftliche Risiko und für die Testpersonen das höchste gesundheitliche Risiko mit sich bringt. Es ist daher nicht verwunderlich, dass sich vergleichsweise wenige Hersteller an der Entwicklung von RSV-Impfstoffen für Kleinkinder versuchen.
Da sich das Problem der infektionsverstärkenden Antikörper in den 1960er Jahren auf den RSV-Totimpfstoff zurückführen ließ, werden in dieser Phase der RSV-Impfstoffentwicklung bewusst andere Impfstofftypen ausprobiert. So setzt Moderna für eine RSV-Impfung von Kleinkindern einen mRNA-Impfstoff ein und Glaxo-Smith-Kline einen Vektor-Impfstoff. Die beiden genbasierten Impfstoff-Typen, die als COVID-19-Impfungen erstmals weltweit zur Anwendung kamen und die gänzlich anders wirken als die klassischen Totimpfstoffe.
Entwicklung von RSV-Impfstoffen (Respiratorisches Synzytial-Virus)
Studienziele nicht erreicht und Studien gestoppt
Wie es um die Effektivität und Sicherheit der nächsten Generation von RSV-Impfstoffen bestellt ist, wird sich voraussichtlich ab der zweiten Hälfte 2023 zeigen. Sowohl bei der europäischen EMA wie bei der US-amerikanischen FDA laufen erste Anträge auf Zulassung von RSV-Impfstoffen. Es handelt sich dabei um den Protein-Impfstoff mit der Bezeichnung RSVPreF3-OA von Glaxo-Smith-Kline für Personen ab 60 Jahren und den Protein-Impfstoff mit der Bezeichnung RSVpreF von Pfizer ebenfalls für Personen ab 60 Jahren.
Auffallend ist, dass derzeit gleich zwei Zulassungsstudien mit Schwangeren pausieren. Bei der Studie von Glaxo-Smith-Kline handelt es sich dem Hersteller nach um ein nicht näher beschriebenes Sicherheitssignal, welches geprüft werden muss. Nach einem Stopp der Studie pausiert diese nun schon seit Februar 2022. Es handelt sich dabei um den gleichen Impfstoff, der in den Studien mit Probanden ab 60 Jahren getestet wird und dort bereits zu mindestens zwei Fällen von Guillain-Barré Syndrom geführt hat – schweren, autoimmunen Erkrankungen des Nervensystems mit aufsteigenden Lähmungen.[7] Bei der Studie von Novavax wurden die Studienziele bisher nicht erreicht. Diese Studie pausiert daher schon seit März 2019.
Auch nicht erreicht wurden die Studienziele bei der Studie mit seronegativen Kleinkindern ab sechs Monaten von Glaxo-Smith-Kline. Diese Studie wird schon seit 2021 nicht in die nächste Studienphase gebracht und pausiert als Zulassungsstudie seitdem ebenfalls. Daten aus den drei pausierenden Studien sind öffentlich nicht einsehbar, bislang fehlen jegliche Informationen zur Art des genannten Sicherheitssignals oder zur Art der nicht erreichten Studienziele.
Tatsächlich weisen in der Anzahl wenige und im Verlauf pausierende Studien an Kleinkindern und Schwangeren darauf hin, dass die Entwicklung eines effektiven und sicheren RSV-Impfstoffes auch mit anderen Impfstoff-Typen bis heute nicht reibungslos verläuft. Ob und welche Rolle dabei auch die Problematik der infektionsverstärkenden Antikörper spielen mag, ist derzeit für die Öffentlichkeit noch nicht einschätzbar. Grundsätzlich gehört eine RSV-Infektion zur großen Gruppe der respiratorischen Atemwegserkrankungen, für die es bis heute an wirksamen Impfstoffen mangelt, da über Impfungen keine ausreichende Schleimhaut-Immunität aufgebaut wird.[8] Die Wirksamkeit und Sicherheit von RSV-Impfstoffen bleibt daher auch kurz vor Zulassung der ersten Präparate zumindest noch zweifelhaft.
Erwartung hoher Marktanteile
Heutzutage, noch bevor erste RSV-Impfstoffe erhältlich sind, wird allen frühgeborenen und vorerkrankten Babys eine Behandlung mit monoklonalen Antikörpern empfohlen. Da es sich bei dem Präparat Synagis um bis zu fünf Injektionen handelt, werden diese häufig ebenfalls als Impfung bezeichnet. Anders als die Impfstoffe, die demnächst zugelassen werden, kommt hier eine passive Immunprophylaxe zum Einsatz. Werden Produkte vom Typ Antikörper und Produkte vom Typ Impfstoffe zusammen betrachtet, ergeben sich beachtliche Prognosen: So wird für RSV-Antikörper und RSV-Impfstoffe bis zum Jahr 2024 ein Marktwert von 2,5 Milliarden US-Dollar erwartet. Bis 2028 könnte dieser Marktwert gar bis auf 9,5 Milliarden US-Dollar ansteigen.[9] Der Wettstreit, die jahrzehnte-lange Lücke ohne Impfungen gegen RSV endlich gewinnbringend zu schließen, ist in vollem Gange.
Auch interessant zu diesem Thema: Wissenslücke # 17 Infektionsverstärkende Antikörper und Wissenslücke #20 Fehlende Werte bei RSV
[1] American Journal of Epidemiology: Field evaluation of a respiratory syncytial virus vaccine and a trivalent parainfluenza virus vaccine in a pediatric population, 01.04.1969
https://academic.oup.com/aje/article-abstract/89/4/449/198872?redirectedFrom=fulltext [2] American Society of Microbiology: Brief History and Characterization of Enhanced Respiratory Syncytial Virus Disease, Clinical and Vaccine Microbiology, 07.03.2016
https://journals.asm.org/doi/10.1128/CVI.00609-15 [3] American Society of Microbiology: Progress toward a Respiratory Syncytial Virus Vaccine, Clinical and Vaccine Microbiology, 07.03.2016
https://journals.asm.org/doi/10.1128/CVI.00037-16 [4] Ärzteblatt: Wenn ein Dengue-Impfstoff schwere Dengue-Erkrankungen fördert, 04.12.2017
https://www.aerzteblatt.de/nachrichten/84794/Wenn-ein-Dengue-Impfstoff-schwere-Dengue-Erkrankungen-foerdert [5] Centers for Disease Control and Prevention: Economics of Vaccinating U.S. Adults ≥60 years-old against Respiratory Syncytial Virus, Advisory Committee on Immunization Practices, 23.02.2023
https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2023-02/slides-02-23/RSV-Adults-03-Ortega-Sanchez-508.pdf [6] European Medicines Agency: Guideline on the clinical evaluation of medicinal products indicated for the prophylaxis or treatment of respiratory syncytial virus (RSV) disease, 18.10.2018
https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-clinical-evaluation-medicinal-products-indicated-prophylaxis-treatment-respiratory_en.pdf [7] Fierce Biotech: FDA flags Guillain-Barré risks for GSK, Pfizer RSV shots, but just one will need safety trial, 28.02.2023
https://www.fiercebiotech.com/biotech/fda-flags-guillain-barre-syndrome-risks-gsk-pfizer-rsk-vaccines-just-one-will-need-post [8] Cell Host & Microbes: Rethinking next-generation vaccines for coronaviruses, influenzaviruses, and other respiratory viruses, 11.01.2023
https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(22)00572-8 [9] Research and Markets: Global Respiratory Syncytial Virus (RSV) Vaccine And Antibody Pipeline Market: Analysis By End User, By Type, By Region, Size and Trends with Impact of COVID-19 and forecast up to 2028, April 2022
https://www.researchandmarkets.com/reports/5579066/global-respiratory-syncytial-virus-rsv-vaccine